ESTRUCTURA
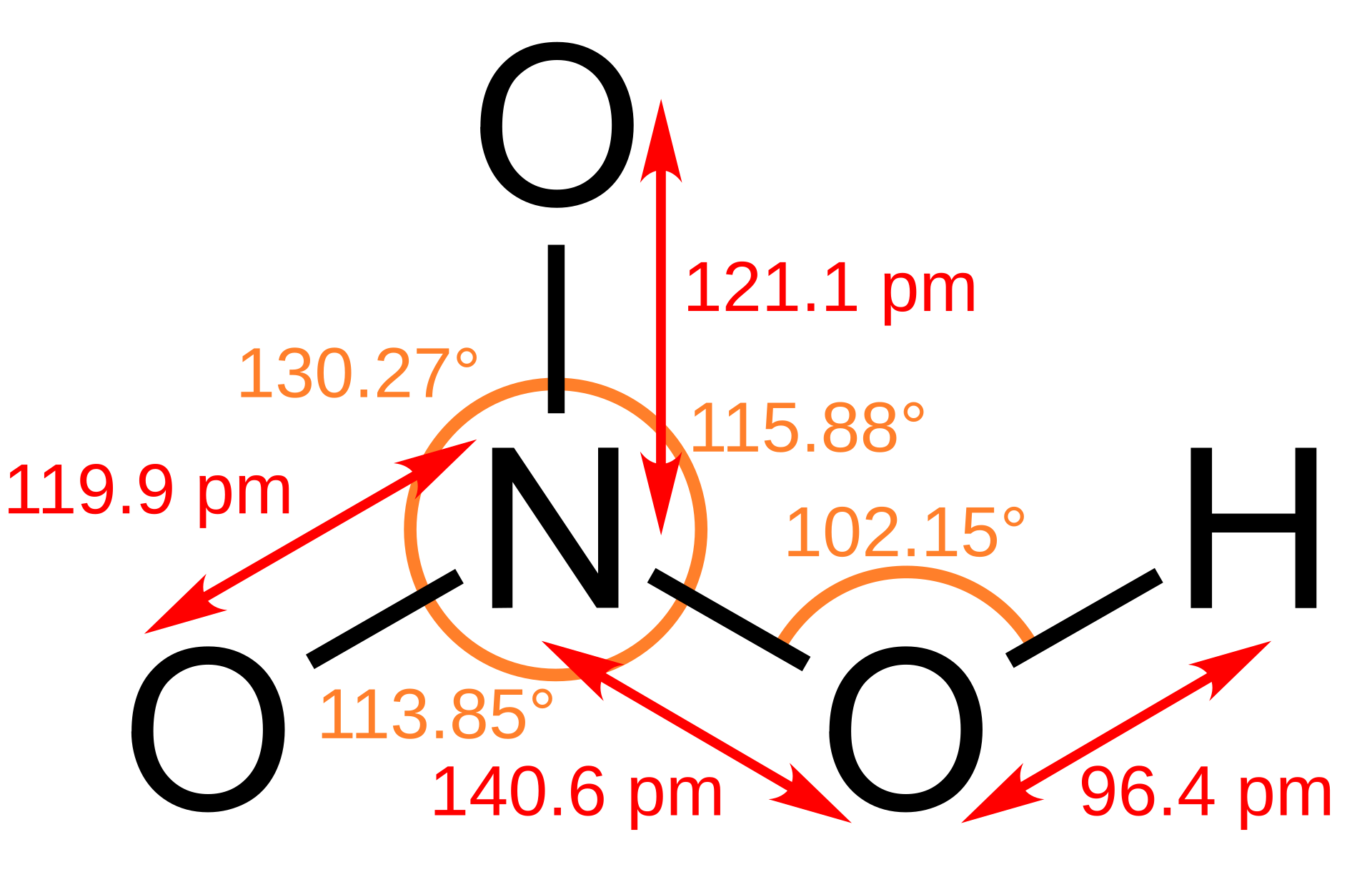
En química, la estructura de una sustancia se refiere a la disposición tridimensional de sus átomos dentro de una molécula o en una red cristalina. Entender la estructura es fundamental porque determina las propiedades físicas y químicas de una sustancia. Por ejemplo, la forma en que los átomos están enlazados y orientados influye en:
Punto de fusión y ebullición:Las interacciones entre moléculas dependen de su forma.
Solubilidad:La polaridad de una molécula, determinada por su estructura, afecta su capacidad para disolverse en diferentes solventes.
Reactividad química:La accesibilidad de ciertos grupos atómicos y la estabilidad de la molécula están ligadas a su configuración espacial.
Propiedades biológicas:En biomoléculas como proteínas o ADN, la estructura tridimensional es crucial para su función.
Estructura primaria:
La secuencia de átomos en una cadena
Estructura secundaria:
La disposición espacial local de una porción de la cadena
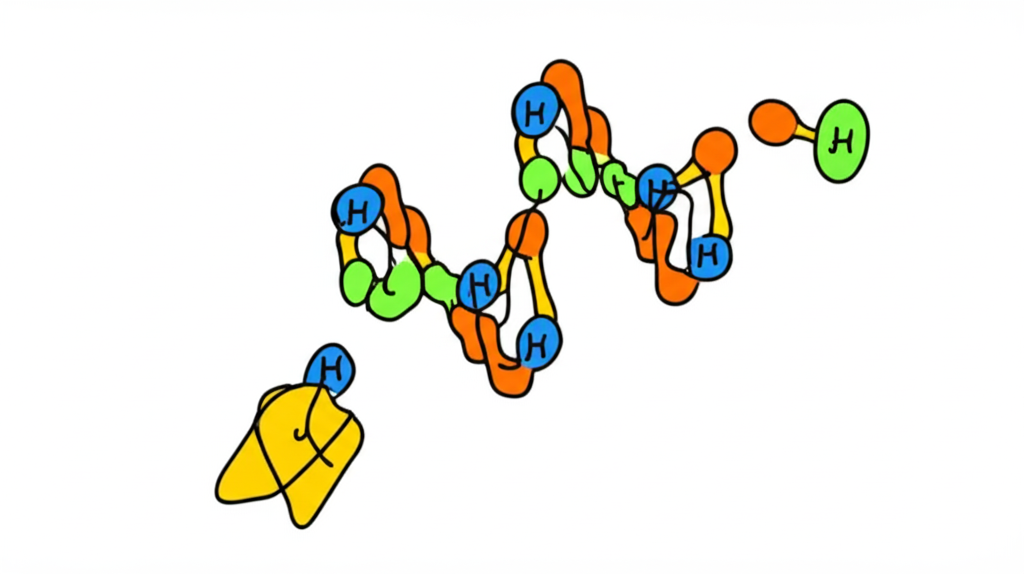
Estructura terciaria:
La disposición tridimensional global de la molécula completa.
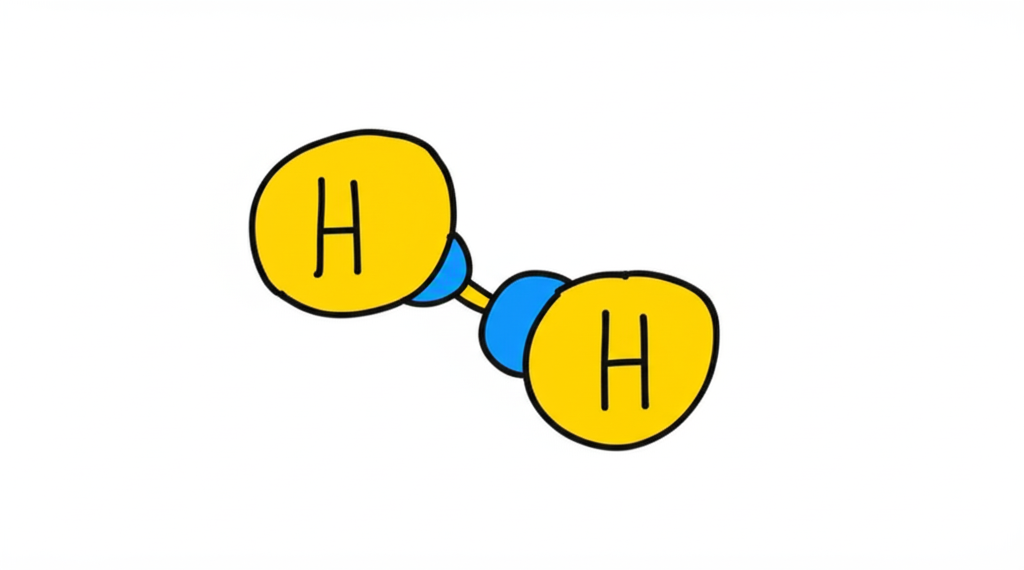
Estructura cuaternaria:
La asociación de múltiples moléculas individuales para formar un complejo más grande

NOMENCLATURA
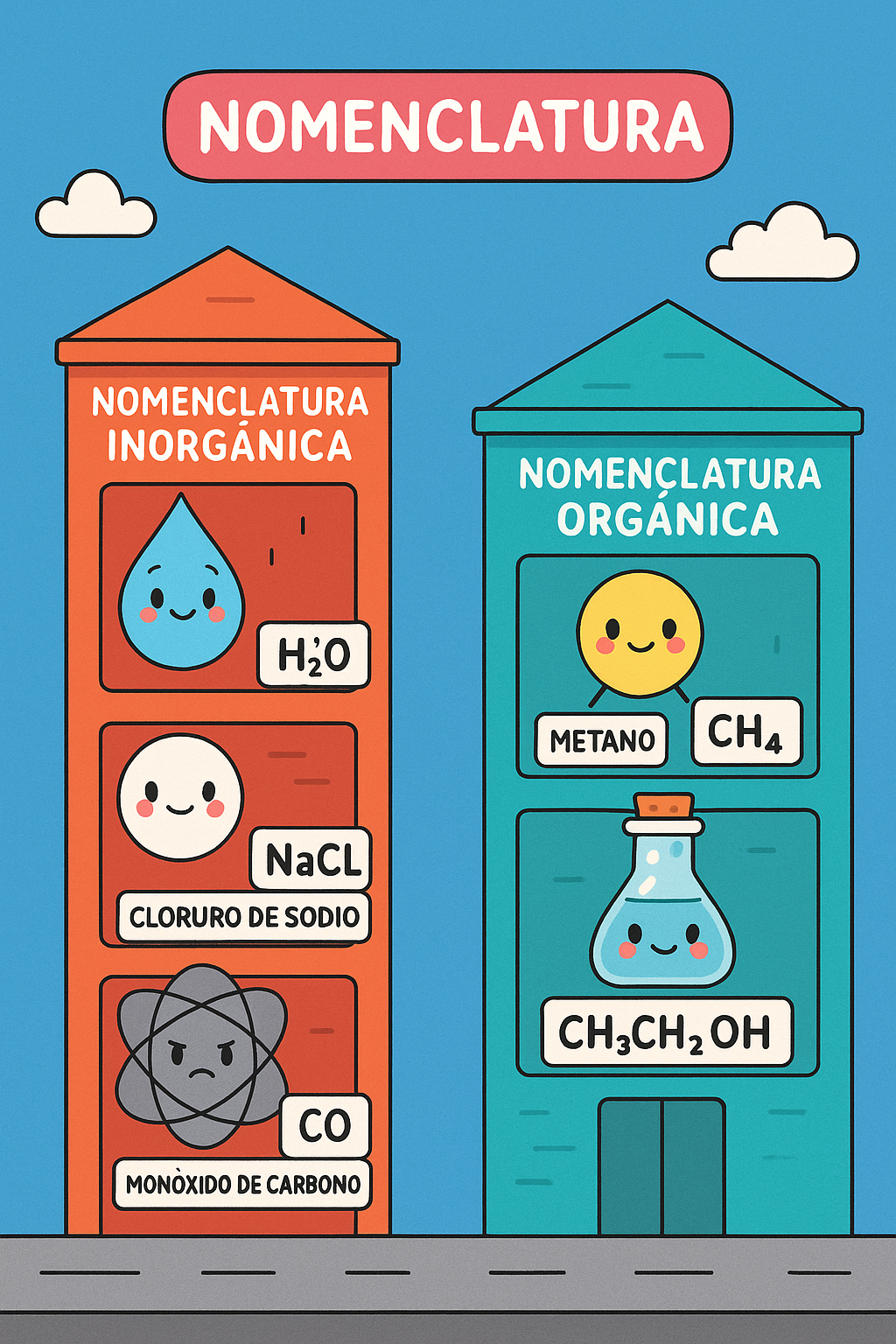
nomenclatura es el sistema de reglas utilizado para nombrar compuestos químicos. Su propósito principal es asegurar que cada compuesto tenga un nombre único y que, a partir de ese nombre, se pueda deducir su estructura química sin ambigüedad. La Unión Internacional de Química Pura y Aplicada (IUPAC) es la autoridad global que establece estas reglas para estandarizar la nomenclatura química en todo el mundo.
Existen varios sistemas de nomenclatura, dependiendo del tipo de compuesto:
- Nomenclatura inorgánica: Se aplica a compuestos que generalmente no contienen enlaces carbono-carbono o carbono-hidrógeno (óxidos, ácidos, sales, hidruros, etc.). Por ejemplo, el H2O se llama agua, pero su nombre sistemático es monóxido de dihidrógeno. El NaCl es cloruro de sodio.
- Nomenclatura orgánica: Se utiliza para compuestos que contienen carbono e hidrógeno, a menudo con otros elementos como oxígeno, nitrógeno, azufre, etc. Estos compuestos suelen tener cadenas de carbono y grupos funcionales específicos. Por ejemplo, el CH4 es metano, y el CH3CH2OH es etanol.
- Las reglas de nomenclatura consideran:
- El número de átomos de cada elemento.
- El tipo de enlaces presentes.
- La presencia de grupos funcionales específicos.
- La isomería (compuestos con la misma fórmula molecular pero diferente estructura).
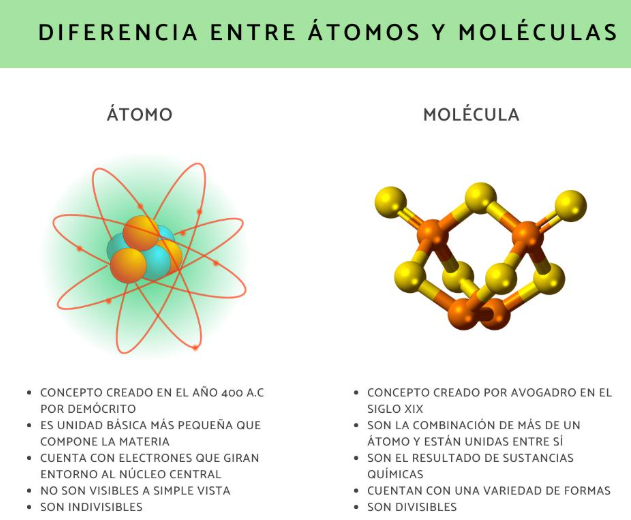
Átomos y Moléculas:
Los átomos son las unidades fundamentales de la materia, compuestos por un núcleo y electrones. Las moléculas son conjuntos de dos o más átomos unidos químicamente.
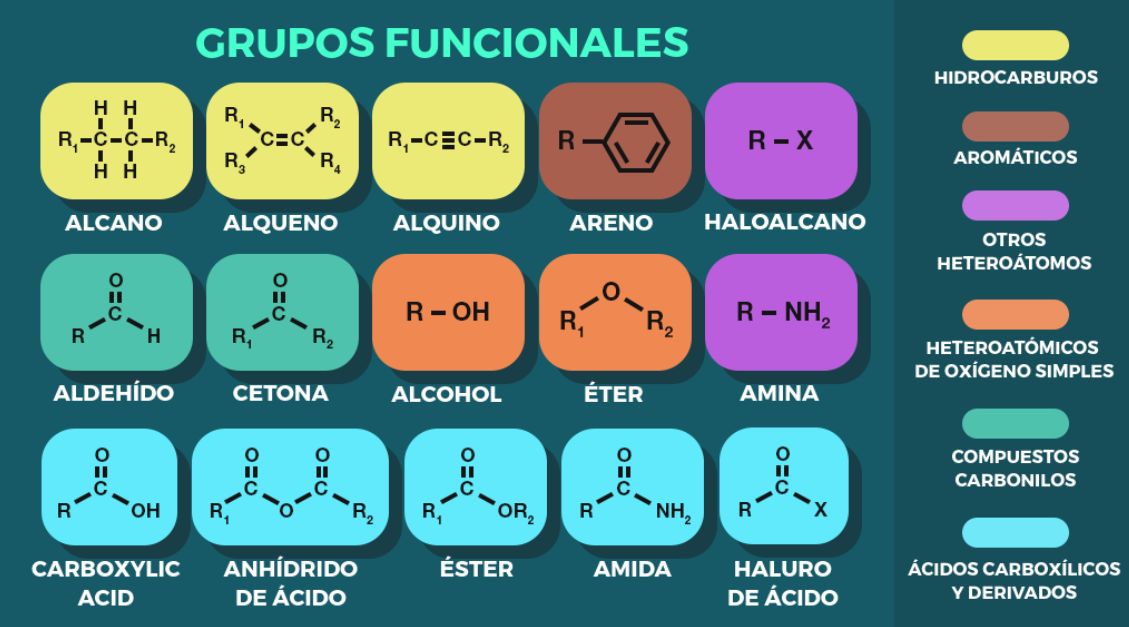
Grupos Funcionales:
Son átomos o grupos de átomos dentro de una molécula que son responsables de sus características químicas particulares. Por ejemplo, el grupo hidroxilo (OH) en alcoholes, o el grupo carboxilo (COOH) en ácidos carboxílicos. La presencia de un grupo funcional a menudo determina las propiedades químicas y la reactividad de un compuesto.
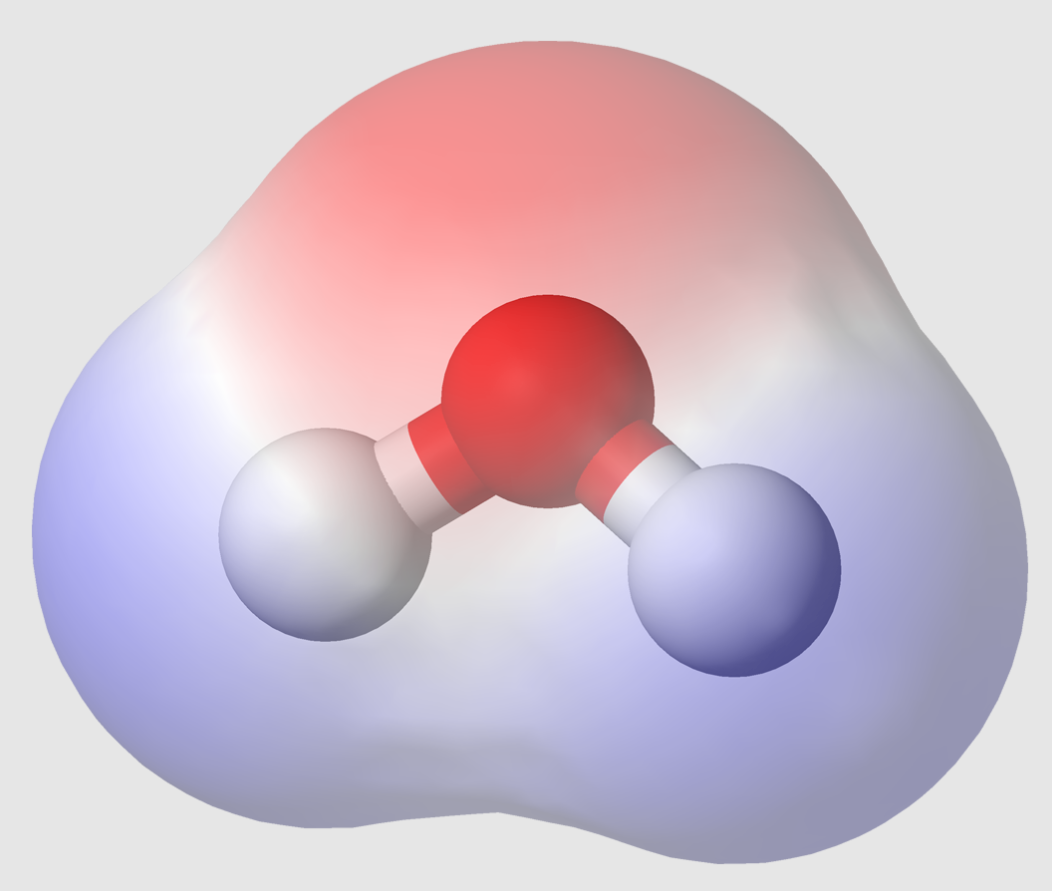
Polaridad:
Se refiere a la distribución desigual de carga eléctrica dentro de una molécula, lo que resulta en un extremo positivo y un extremo negativo (un dipolo). La polaridad de una molécula afecta su solubilidad y sus puntos de fusión/ebullición.
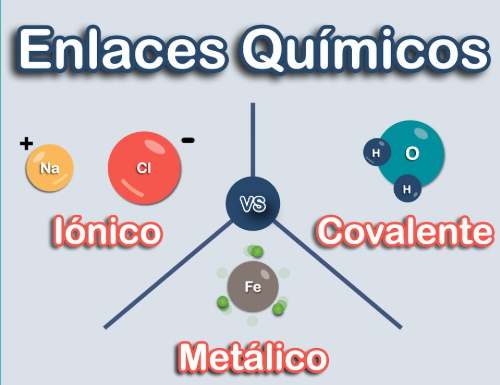
Enlaces Químicos:
Son las fuerzas que mantienen unidos a los átomos. Los tipos principales son:
- Iónicos: Transferencia de electrones entre átomos, formando iones (por ejemplo, NaCl).
- Covalentes: Compartición de electrones entre átomos (por ejemplo, H2O, CH4).
- Metálicos: Red de iones metálicos rodeados por un "mar" de electrones deslocalizados.
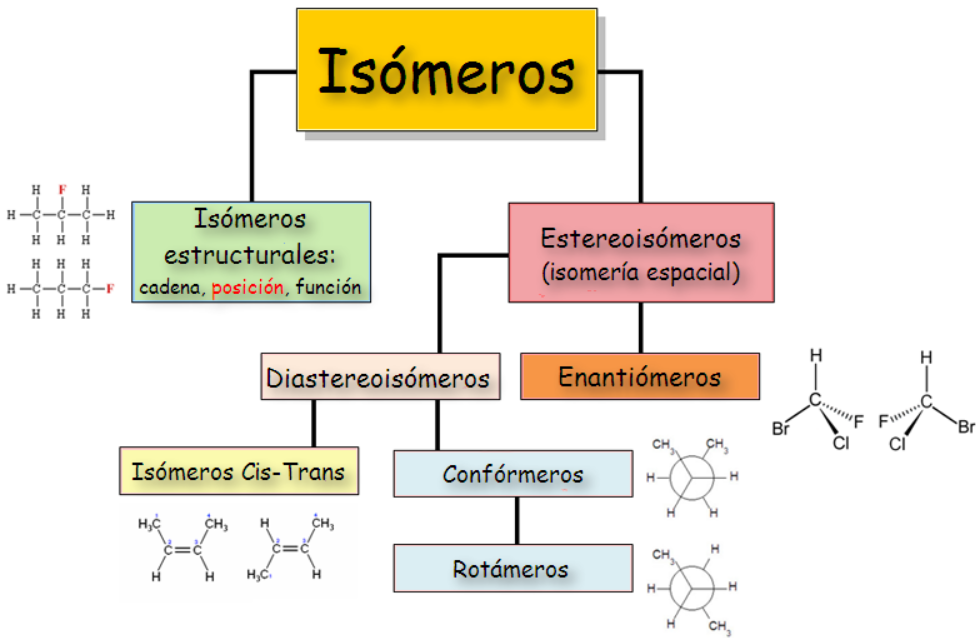
Isomería:
Es la propiedad de ciertos compuestos químicos de tener la misma fórmula molecular pero diferentes estructuras. Esto lleva a propiedades físicas y químicas distintas. Hay varios tipos:
- Isómeros estructurales (o constitucionales): Difieren en la forma en que los átomos están conectados.
- Estereoisómeros: Tienen la misma conectividad, pero difieren en la disposición tridimensional de los átomos (por ejemplo, isómeros geométricos y ópticos).