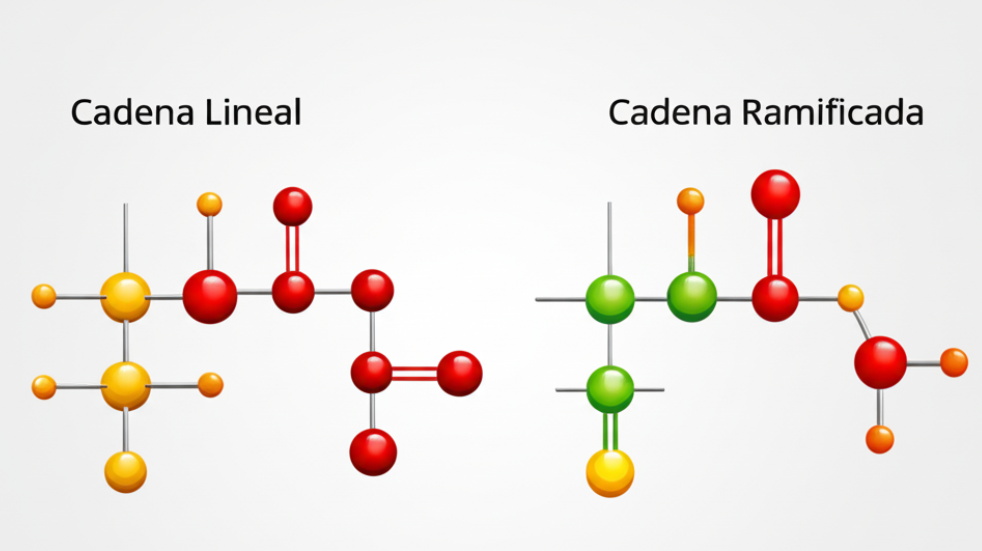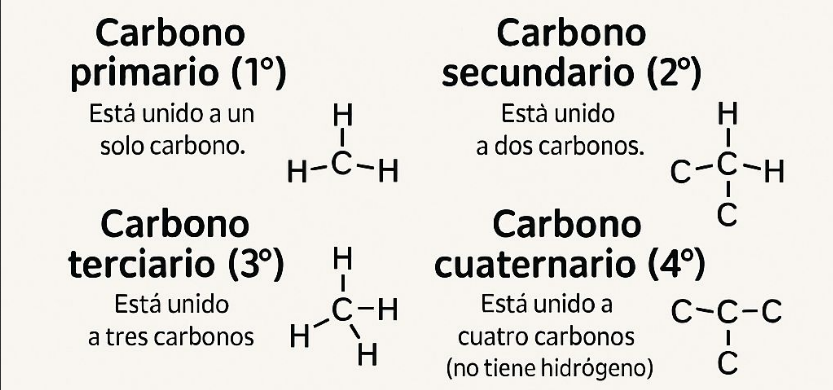
1. Según el número de átomos de carbono unidos al carbono en cuestión:
-
Carbono primario (1°): Está unido a un solo carbono.
-
Carbono secundario (2°): Está unido a dos carbonos.
-
Carbono terciario (3°): Está unido a tres carbonos.
-
Carbono cuaternario (4°): Está unido a cuatro carbonos (no tiene hidrógenos).
El término "carbono primario" se refiere a un átomo de carbono que está unido a un solo otro átomo de carbono.
2. Ejemplo: Un ejemplo común es el metano (CH₄), donde el carbono central es un carbono primario, ya que está unido solo a átomos de hidrógeno.
3. Reactividad: Los carbonos primarios suelen ser menos reactivos en comparación con los carbonos secundarios o terciarios, especialmente en reacciones como la halogenación o la formación de carbocationes.
4. Importancia en química orgánica: La identificación del tipo de carbono (primario, secundario o terciario) es fundamental para entender la reactividad y las propiedades químicas de los compuestos orgánicos.
El "carbono secundario" es un término utilizado en química orgánica para describir un átomo de carbono que está unido a dos átomos de carbono.
1. Estructura: Un carbono secundario generalmente se encuentra en el medio de una cadena de carbono, no en los extremos.
2. Ejemplo: Un ejemplo común de un compuesto que contiene un carbono secundario es el etanol (C₂H₅OH), donde el carbono central está unido a otros dos carbonos.
3. Reactividad: Los carbonos secundarios son más reactivos que los carbonos primarios, especialmente en reacciones como la formación de carbocationes. Esto se debe a que tienen más estabilidad al formar un carbocationo secundario en comparación con uno primario.
4. Importancia en química orgánica: Conocer la clasificación de los carbonos (primarios, secundarios y terciarios) es esencial para predecir la reactividad y las propiedades de los compuestos orgánicos.
El "carbono terciario" es un término en química orgánica que se refiere a un átomo de carbono que está unido a tres átomos de carbono.
2. Ejemplo: Un ejemplo común de un compuesto que tiene un carbono terciario es el isopropanol (C₃H₇OH), donde el carbono central está unido a dos grupos metilo y a un grupo hidroxilo.
3. Reactividad:Los carbonos terciarios son más reactivos que los carbonos primarios y secundarios en reacciones como la formación de carbocationes. La estabilidad del carbocationo terciario es mayor debido a la hiperconjugación y el efecto inductivo de los grupos alquilo adyacentes.
4. Importancia en química orgánica: La identificación del tipo de carbono es esencial para predecir la reactividad y las propiedades de los compuestos orgánicos, así como para entender las rutas de reacción en síntesis orgánica.
El "carbono cuaternario" es un término en química orgánica que se refiere a un átomo de carbono que está unido a cuatro átomos de carbono. Es decir, es un carbono que no tiene enlaces con átomos de hidrógeno, ya que todos sus enlaces están ocupados por otros carbonos.
1. Estructura: Un carbono cuaternario se encuentra en el interior de una cadena de carbono y está típicamente rodeado por otros carbonos.
2. Ejemplo: Un ejemplo común de un compuesto con un carbono cuaternario es el ciclohexano (C₆H₁₂), donde cada carbono en el ciclo puede considerarse como cuaternario si está conectado a otros tres carbonos.
3. Reactividad: Los carbonos cuaternarios son menos reactivos en comparación con los carbonos primarios, secundarios y terciarios, especialmente en reacciones que involucran la formación de carbocationes, ya que no pueden formar carbocationes estables.
4. Importancia en química orgánica: La identificación de carbonos cuaternarios es importante para entender la estructura y propiedades de los compuestos orgánicos, así como su comportamiento en reacciones químicas.
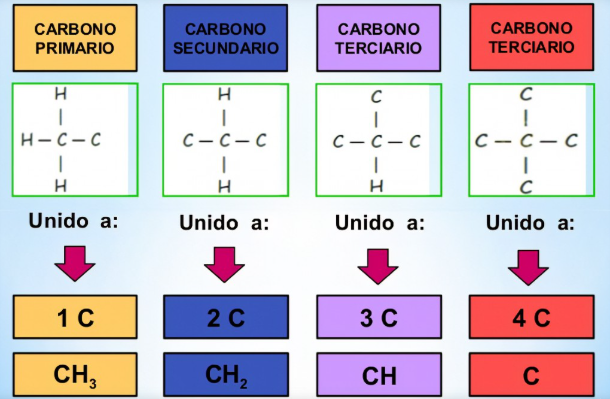
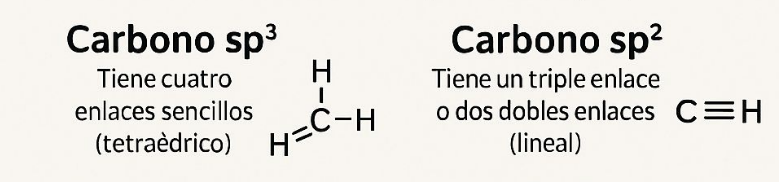
2. Según el tipo de hibridación:
-
Carbono sp³: Tiene cuatro enlaces sencillos (tetraédrico).
-
Carbono sp²: Tiene un doble enlace y dos enlaces sencillos (trigonal planar).
-
Carbono sp: Tiene un triple enlace o dos dobles enlaces (lineal).
Aquí tienes algunos puntos clave sobre el carbono sp³:
1. Estructura: En la hibridación sp³, el carbono forma cuatro enlaces simples con otros átomos. Cada uno de estos enlaces se forma a partir de un orbital híbrido sp³.
2. Ejemplo: Un ejemplo clásico de un compuesto que contiene carbono sp³ es el metano (CH₄). En el metano, el carbono está unido a cuatro átomos de hidrógeno mediante enlaces simples, y la disposición de los enlaces forma una estructura tetraédrica.
3. Propiedades: Los compuestos que contienen carbono sp³ tienden a ser más saturados, lo que significa que tienen un mayor número de enlaces simples y menos insaturaciones (dobles o triples enlaces).
4. Reactividad: Los carbonos sp³ son generalmente menos reactivos en comparación con los carbonos hibridados sp² (que tienen enlaces dobles) o sp (que tienen enlaces triples). Sin embargo, pueden participar en reacciones como la combustión o la halogenación.
5. Importancia en química orgánica: La hibridación sp³ es fundamental para entender la estructura y las propiedades de muchos compuestos orgánicos, incluidos los alcanos y otros hidrocarburos saturados.
Aquí tienes algunos puntos clave sobre el carbono sp²:
1. Estructura: En la hibridación sp², el carbono forma tres enlaces: dos enlaces simples y uno enlace doble. El enlace doble se forma a partir de un orbital híbrido sp² y un orbital p que no se hibrida.
2. Ejemplo: Un ejemplo común de un compuesto que contiene carbono sp² es el etileno (C₂H₄). En el etileno, cada carbono está unido a dos átomos de hidrógeno y al otro carbono mediante un enlace doble, lo que da lugar a una estructura plana.
3. Propiedades: Los compuestos con carbonos sp² tienden a ser insaturados debido a la presencia de enlaces dobles, lo que les confiere propiedades químicas diferentes en comparación con los compuestos saturados (carbonos sp³).
4. Reactividad: Los carbonos sp² son más reactivos que los carbonos sp³ debido a la presencia de enlaces dobles. Estos enlaces pueden participar en reacciones como la adición electofílica, donde reactivos pueden añadirse al doble enlace.
5. Importancia en química orgánica: La hibridación sp² es crucial para entender la estructura y las propiedades de muchos compuestos orgánicos, incluidos los alquenos y otros sistemas que contienen enlaces dobles.
Aquí tienes algunos puntos clave sobre el carbono sp:
1. Estructura: En la hibridación sp, el carbono forma dos enlaces: un enlace triple o dos enlaces dobles. Cada uno de estos enlaces se forma a partir de un orbital híbrido sp y un orbital p que no se hibrida.
2. Ejemplo: Un ejemplo común de un compuesto que contiene carbono sp es el etino (C₂H₂), también conocido como acetileno. En el etino, cada carbono está unido al otro mediante un enlace triple, lo que da lugar a una estructura lineal.
3. Propiedades: Los compuestos con carbonos sp tienden a ser altamente insaturados debido a la presencia de enlaces triples, lo que les confiere propiedades químicas muy reactivas.
4. Reactividad: Los carbonos sp son más reactivos que los carbonos sp² y sp³ debido a la naturaleza del enlace triple. Pueden participar en diversas reacciones, incluyendo reacciones de adición y sustitución.
5. Importancia en química orgánica: La hibridación sp es fundamental para entender la estructura y las propiedades de muchos compuestos orgánicos, incluidos los alquinos y otros sistemas que contienen enlaces triples.
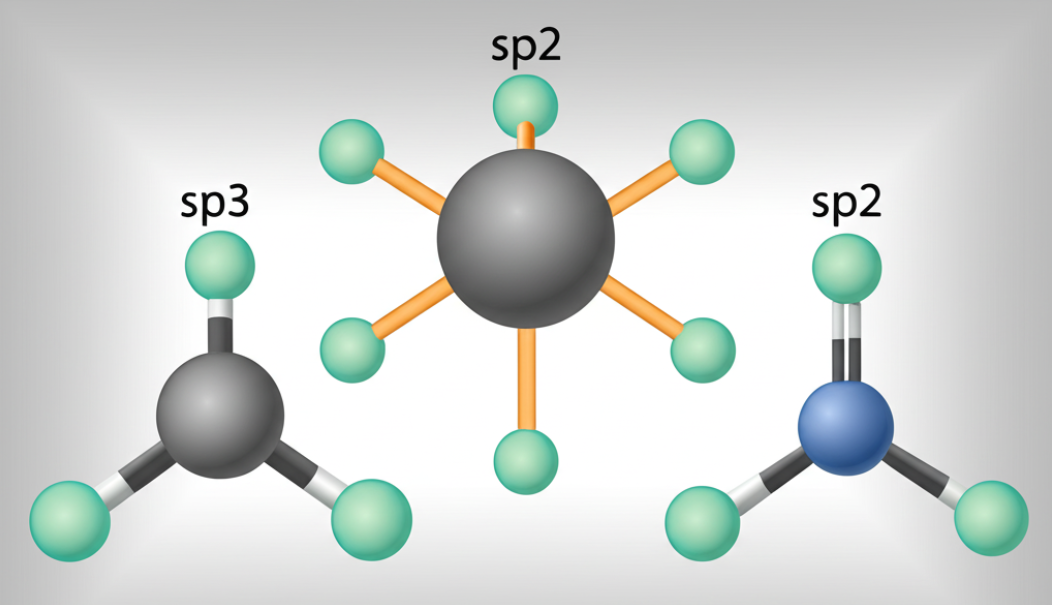
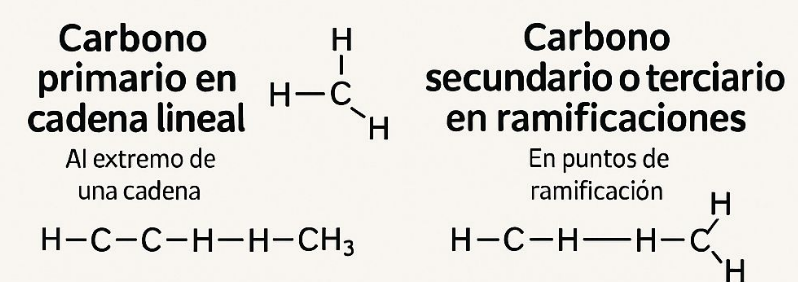
3. Según la posición en compuestos cíclicos o ramificados:
-
Carbono primario en cadena lineal: Al extremo de una cadena.
-
Carbono secundario o terciario en ramificaciones: En puntos de ramificación.
El carbono *primario* en una cadena lineal es aquel que está unido a un solo átomo de carbono vecino.
En otras palabras, un carbono primario está ubicado en el extremo de una cadena de carbonos y tiene tres enlaces con átomos de hidrógeno (o con otros grupos funcionales) y uno con otro carbono.
Aquí tienes algunos puntos clave sobre el carbono primario en una cadena lineal:
1. Ubicación: En una cadena lineal, los carbonos primarios se encuentran en los extremos de la cadena. Por ejemplo, en el butano (C₄H₁₀), los carbonos en las posiciones 1 y 4 son carbonos primarios.
2. Ejemplo: En el butano:
- La estructura es CH₃-CH₂-CH₂-CH₃.
- Los carbonos en los extremos (CH₃) son carbonos primarios, ya que cada uno está unido a un solo carbono (el del medio).
3. Propiedades: Los carbonos primarios tienden a ser más reactivos en ciertas reacciones químicas, como las reacciones de halogenación, donde la sustitución ocurre más fácilmente en estos carbonos debido a su menor estabilidad relativa comparado con carbonos secundarios o terciarios.
4. Importancia: Identificar carbonos primarios es esencial para entender la reactividad y la estabilidad de los compuestos orgánicos, así como su comportamiento en diferentes reacciones químicas.
El "carbono terciario" es un término en química orgánica que se refiere a un átomo de carbono que está unido a tres átomos de carbono.
Carbono Secundario
Un carbono *secundario* es aquel que está unido a dos átomos de carbono vecinos. En una ramificación, esto significa que el carbono secundario está conectado a un carbono primario (en el extremo de una cadena) y a otro carbono (que puede ser primario o secundario).
- Ejemplo: En el isobutano (C₄H₁₀), la estructura es CH₃-CH(CH₃)-CH₃. El carbono marcado como CH (que está unido a dos grupos CH₃) es un carbono secundario.
Carbono Terciario
Un carbono *terciario* es aquel que está unido a tres átomos de carbono vecinos. En una ramificación, esto significa que el carbono terciario está conectado a tres otros carbonos.
- Ejemplo: En el 2-metilpropano, la estructura es (CH₃)₂CH-CH₃. El carbono central (el que está unido a los dos grupos metilo) es un carbono terciario porque está conectado a tres carbonos (dos CH₃ y uno CH₂).
Importancia en Ramificaciones
1. Estabilidad: Los carbonos terciarios tienden a ser más estables que los secundarios debido al efecto inductivo y la hiperconjugación, lo que puede influir en la reactividad de los compuestos en reacciones químicas.
2. Reactividad: Los compuestos con carbonos terciarios pueden ser más reactivos en ciertas reacciones, como las reacciones de eliminación o sustitución nucleofílica, debido a su estructura.
3. Identificación: Reconocer si un carbono es primario, secundario o terciario es crucial para predecir cómo reaccionará en diferentes condiciones químicas.